La spettroscopia di
Risonanza Magnetica Nucleare (NMR) è una tecnica analitica strumentale che permette di ottenere dettagliate
informazioni sulla struttura molecolare dei composti in esame.
La spettroscopia NMR
misura l’assorbimento di radiazione elettromagnetica di frequenza radio in molecole
immerse in un forte campo magnetico. Queste radiazioni provocano transizioni di spin nucleare in
particolari atomi (tipicamente 1H
o 13C). Quindi, con la
spettroscopia NMR, le informazioni sulla struttura molecolare vengono dedotte
osservando il comportamento dei nuclei atomici.
La rotazione dei nuclei atomici su se stessi è capace di procurare un momento magnetico  ad alcuni di essi.
ad alcuni di essi.
 ad alcuni di essi.
ad alcuni di essi.
Con la tecnica NMR sono
osservabili solo i nuclei che possiedono un momento magnetico nucleare di spin, e che quindi si comportano
come l’ago di una bussola che si può orientare in un campo magnetico applicato.
Lo spin nucleare viene
prodotto dalle particelle che costituiscono il nucleo, protoni e neutroni.
In molti atomi (come nel
12C) gli spin sono tutti
appaiati, uno in opposizione all'altro e quindi si annullano reciprocamente e
il nucleo atomico ha uno spin risultante I uguale a zero. In alcuni atomi, però (come in 1H e in 13C), il nucleo possiede
uno spin risultante I diverso
da zero.
Queste si comportano
come se fossero in rotazione (spin) attorno al loro asse e hanno spin 1/2.
Il più semplice tra gli elementi aventi momento
magnetico nucleare, ed il più importante a fini pratici, è l'idrogeno.
Quando
un nucleo dotato di spin viene immerso in un campo magnetico, il nucleo, come
l'ago di una bussola, è sottoposto ad una coppia di forze che lo fanno ruotare
per allinearlo col campo magnetico esterno.
Le possibili
orientazioni che il nucleo può assumere in un campo magnetico sono governate dal
numero quantico m che può
assumere i valori da –I a
+I (con incrementi di una
unità) e quindi può assumere 2I +
1 valori diversi. Nel caso di un nucleo con spin 1/2 (come 1H) ci sono 2 possibili
orientazioni: una con m =
- 1/2
e una con m = +1/2. Il
momento magnetico nucleare
non rimane
fermo, ma continua ad oscillare attorno alla direzione del campo magnetico
applicato Bo compiendo un moto di
precessione simile a quello di una trottola. I due stati possibili
del nucleo non hanno la stessa energia, ma lo stato con m = +1/2 (allineato con il campo)
si trova ad energia leggermente più bassa di quello con m = - 1/2 (opposto al campo).
Il moto di precessione
dei momenti magnetici nucleari avviene con una frequenza proporzionale alla
differenza di energia tra i due livelli detta frequenza di Larmor. All’aumentare del campo applicato Bo, aumenta la frequenza di Larmor e quindi aumenta la differenza di energia tra i due
livelli. La differenza di energia tra i due livelli è piccolissima, di
conseguenza la popolazione di nuclei nei due stati è quasi identica ma con una
piccola prevalenza per lo stato a bassa energia, allineato con il campo. Sono
proprio questi pochi nuclei in eccesso allineati con il campo magnetico quelli
che permettono di generare il segnale NMR.
Se il campione viene irradiato con una radiazione elettromagnetica di
frequenza uguale alla frequenza di Larmor, si ha un'interazione della
componente magnetica della radiazione con i momenti magnetici nucleari anche
questi oscillanti alla frequenza di Larmor. L'energia può essere così trasferita
ai nuclei. Ogni assorbimento di radiazione comporta un cambiamento di
orientazione dello spin nucleare che ruota da allineato con il campo ad opposto
al campo. Quando si verifica questa transizione di spin si dice che i nuclei
sono in risonanza con la radiazione applicata, da qui il nome di Risonanza Magnetica Nucleare, NMR.
Esistono due metodi per ricavare quest'informazione. Nella spettroscopia NMR ad onda continua, un elettromagnete genera il campo magnetico necessario ad indurre lo splitting
tra i livelli energetici degli atomi attivi nel campione in esame.
Contemporaneamente, un emettitore di onde elettromagnetiche lo bombarda
ad una frequenza ben precisa. Il campo magnetico della calamita viene
quindi incrementato passo passo: un rivelatore registra l'assorbanza del campione ad ogni intensità di campo, ovvero quanta parte della
radiazione incidente si perde al passaggio attraverso il mezzo. Come detto sopra, la frequenza di risonanza di un nucleo attivo è
direttamente proporzionale al campo applicato: mano a mano che il campo
aumenta, crescono anche le frequenze di risonanza. Quando le frequenze
di risonanza diventano pari a quella incidente (che invece è costante),
allora tutti gli atomi capaci di farlo assorbiranno quanti di energia, e
l'assorbanza misurata sarà più alta.
Il secondo metodo, usato dagli spettrometri più moderni, consiste nel
mantenere costante il campo, incrementando invece la frequenza della
radioonda incidente.
Dal punto di vista pratico, il risultato è sempre un grafico con
l'assorbanza sull'asse delle y, ed una quantità utile a definire
l'energia fornita sull'asse delle x.
Ogni nucleo attivo, quindi, entra in risonanza con il campo esterno
alla sua frequenza, per cui tutti gli isotopi uguali sembrerebbero comportarsi allo stesso modo. Nella realtà, invece, i nuclei attivi sono immersi in un intorno chimico, altri atomi, altre molecole, li circondano, con le relative nubi
elettroniche, ed anche esso stesso è circondato dalla sua "nube" di
particelle cariche in moto.
Il campo magnetico applicato induce, sull'intorno elettronico di ogni nucleo, un campo magnetico locale opposto. La nube elettronica provoca cioè una modulazione locale del campo applicato, detta schermatura. Il campo effettivo residuo viene indicato  . Dove
. Dove  è lo schermo elettronico (attenzione:
è lo schermo elettronico (attenzione:  non è ancora lo spostamento chimico!). Rivisitando la formula della frequenza di Larmor:
non è ancora lo spostamento chimico!). Rivisitando la formula della frequenza di Larmor:
 . Dove
. Dove  è lo schermo elettronico (attenzione:
è lo schermo elettronico (attenzione:  non è ancora lo spostamento chimico!). Rivisitando la formula della frequenza di Larmor:
non è ancora lo spostamento chimico!). Rivisitando la formula della frequenza di Larmor: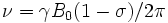
Cioè, a seconda dell'intorno chimico di un certo nucleo, la frequenza di risonanza può risultare più bassa di un fattore  ,
poiché solitamente il campo magnetico indotto è opposto a quello
applicato. Osservando la posizione relativa dei picchi di assorbimento, è
possibile fare considerazioni sullo schermo elettronico associato ai
vari nuclei che li hanno generati.
,
poiché solitamente il campo magnetico indotto è opposto a quello
applicato. Osservando la posizione relativa dei picchi di assorbimento, è
possibile fare considerazioni sullo schermo elettronico associato ai
vari nuclei che li hanno generati.
 ,
poiché solitamente il campo magnetico indotto è opposto a quello
applicato. Osservando la posizione relativa dei picchi di assorbimento, è
possibile fare considerazioni sullo schermo elettronico associato ai
vari nuclei che li hanno generati.
,
poiché solitamente il campo magnetico indotto è opposto a quello
applicato. Osservando la posizione relativa dei picchi di assorbimento, è
possibile fare considerazioni sullo schermo elettronico associato ai
vari nuclei che li hanno generati.
Lo spostamento chimico si ricava mettendo in relazione gli schermaggi dei vari nuclei con uno standard. Nell'NMR del C-13 e del protone si usa il tetrametilsilano (TMS).
L'atomo di silicio è il meno elettronegativo dei tre elementi che
costituiscono il TMS (Si=1,91; H=2.1; C=2.55), ciò giustifica il fatto
che carbonio ed idrogeno siano altamente schermati: si dice che il
silicio è elettron-donatore. Inoltre, grazie all'alta simmetria
della molecola, tutti gli atomi di carbonio e tutti gli atomi di
idrogeno sono schermati nella stessa misura.
Sia  lo schermo elettronico associato ad un certa famiglia di protoni: la frequenza di Larmor risulterà
lo schermo elettronico associato ad un certa famiglia di protoni: la frequenza di Larmor risulterà
 lo schermo elettronico associato ad un certa famiglia di protoni: la frequenza di Larmor risulterà
lo schermo elettronico associato ad un certa famiglia di protoni: la frequenza di Larmor risulterà
Analogamente, se  TMS è quello associato ai protoni del tetrametilsilano,
TMS è quello associato ai protoni del tetrametilsilano,
 TMS è quello associato ai protoni del tetrametilsilano,
TMS è quello associato ai protoni del tetrametilsilano,
La distanza tra i due picchi di assorbimento allora è:



















